Подпишитесь на рассылку от портала rak-gortani.ru
Будьте в курсе последних новостей и мероприятий!
А.О. Гузь, А.С. Захаров, А.В. Гарев
ГБУЗ «Челябинский областной клинический онкологический диспансер»; Россия 454018, Челябинск, ул. Блюхера, 42;
ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Минздрава России; Россия 454092, Челябинск, ул. Воровского, 64
Лечение рецидива рака гортани остается клинически сложной задачей. Перистомальный рецидив – одно из тяжелых осложнений рака гортани, встречается у 2–15 % пациентов после ларингэктомии, имеет неблагоприятный прогноз: 2-летняя выживаемость составляет 45 % у пациентов с I и II стадиями рецидива (по G.A. Sisson) и 9,0 % у пациентов с III и IV стадиями. Развитие стомального рецидива происходит в течение 2 лет после оперативного вмешательства. На его развитие влияют такие главные факторы, как расположение опухоли в подскладочном отделе гортани, размер первичной опухоли, наличие регионарных метастазов, наложенная до ларингэктомии трахеостома, подслизистое распространение опухоли на трахею. Это необходимо учитывать при назначении адъювантной терапии и выборе лечения у первичных пациентов с учетом патогенетических механизмов развития стомального рецидива.
При многообразии оценок клинической картины и факторов формирования перистомального рецидива при раке гортани требуется современная оценка с учетом комплексного подхода к лечению основного заболевания с целью достижения низкого уровня развития стомального рецидива.
Ключевые слова: рак гортани, факторы риска, перистомальный рецидив, ларингэтомия, лимфаденэктомия.
Клиническое решение задачи лечения рецидива рака гортани, как правило, осложняется проведенной ранее консервативной терапией – лучевой или химиолучевой, что меняет физиологические и функциональные свойства тканей. Хирургическое вмешательство, по мнению большинства авторов, – это предпочтительный метод лечения рецидива рака гортани. При начальных, рано выявленных формах рецидива возможно лечение с помощью СО 2-лазера, при эндоларингеальном хирургическом вмешательстве и выполнении открытых резекций гортани в различных вариантах при строгом отборе пациентов [1]. Повторное облучение с использованием различных радиомодификаторов может быть предложено пациентам при нерезектабельном рецидиве [2–4]. Основным методом лечения для большинства пациентов остается ларингэктомия. В иностранной литературе ее чаще называют операцией спасения (salvage surgery).
Основные недостатки такого рода операций – это высокий уровень инвалидизации пациентов и, как следствие, потеря работы и социальная разобщенность. Несмотря на выполнение радикального объема хирургического вмешательства, ларингэктомия не гарантирует высоких показателей общей выживаемости, отсутствия рецидива опухоли в области первичного очага, появления регионарных метастазов и прогрессирования заболевания. Перистомальный рецидив (ПР) в области трахеостомы признается большинством авторов одним из самых тяжелых, часто с летальным исходом, осложнений, возникающих после ларингэктомии.
Еще в 1965 г. W.F. Keim и соавт. [5] опубликовали научную статью, посвященную рецидиву рака гортани в области трахеостомы, в которой впервые ввели для него термин «диффузная опухолевая инфильтрация на стыке трахеи и окружающих мягких тканей». Позднее, в 1979 г., это определение было уточнено и значительно детализировано R.A. Weisman [6]: к нему стали относить область рецидива вокруг трахеостомы с разрастанием ткани, изъязвлением поверхности, появлением бляшек, экзофитным ростом или инфильтрацией. В настоящее время это понятие включает в себя как непосредственный рецидив по краю трахеостомы, так и поражение паратрахеальных лимфатических узлов и их рост вокруг трахеостомы, а также прочие проявления подобной клиники и жалобы на них.
Несмотря на агрессивную хирургическую тактику и современные возможности лучевой, химио- и таргентной терапии, выживаемость этой группы пациентов остается очень низкой. Таким образом, в послеоперационном наблюдении пациентов с опухолью гортани необходимо сосредоточиться на профилактике рецидива и определении факторов риска его возникновения.
Многие авторы приводят статистику заболеваемости и послеоперационных исходов лечения рака гортани. J. Yotakis и соавт. считают, что формирование ПР после ларингэктомии варьирует от 1,7 до 25,0 % случаев [7], а в опубликованной в 2007 г. статье A.L. Sartini и соавт. [8] сообщается о 10,6 % рецидивов в области трахеостомы у пациентов, перенесших ларингэктомию. Рецидив у пациентов возникает чаще в течение 1-го года после ларингэктомии (в 65,0 % случаев), кроме этого, имеется значительная разница между 1-м и 2-м годом после операции [1]. В 98,0 % случаев ПР развивается в течение 2 лет от начала лечения. В 1986 г. L.P. Kowalski [9] сообщает, что время до развития рецидива в среднем равно 5,5 мес. Наибольший период наблюдения между операцией и рецидивом, описанный в литературе, составил 17 лет [10], при этом для подтверждения рецидива и исключения 2-й опухоли авторы провели генетический анализ первичной опухоли и рецидива.
Несмотря на достаточно большой опыт изучении ПР, патогенез его развития не установлен. Практика показывает, что прогноз для рецидива неблагоприятный и большинство пациентов умирают в течение 2 лет после оперативного вмешательства. Статистика свидетельствует, что основными причинами смертности являются:
Для учета рецидивов ПР, их стадирования и определения прогноза G.A. Sisson и соавт. [11] в 1975 г. разработали классификацию ПР, которая не изменялась до настоящего момента, и выбор тактики лечения до сих пор осуществляется по описанным ими критериям.
Приводим стадирование ПР, предложенное G.A. Sisson [12]:
Возможна инвазия в магистральные сосуды шеи, средостения. Прогноз плохой: хирургическое лечение должно обеспечивать хорошие показатели общей выживаемости при сохранении качества жизни пациента. Пациенты погибают от метастазов в легкие, поражения средостения с развитием компрессии трахеи и бронхов, сопровождающейся развитием пневмонии.
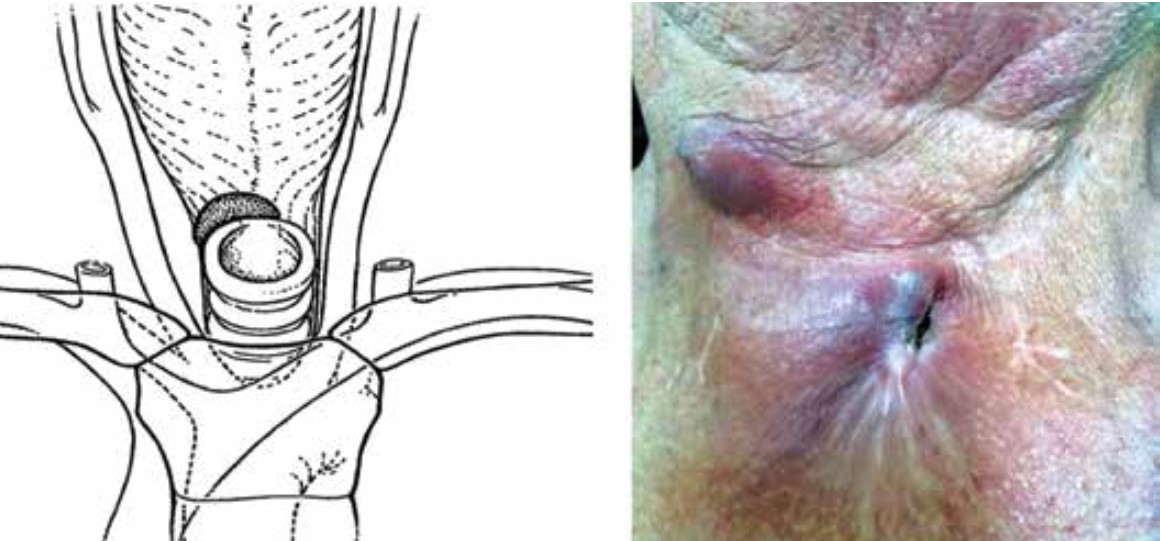
Рис. 1. Представление I стадии перистомального рецидива по G.A. Sission (адаптировано из [12]) и фото пациента с указанной стадией. Отмечается сужение трахеостомы
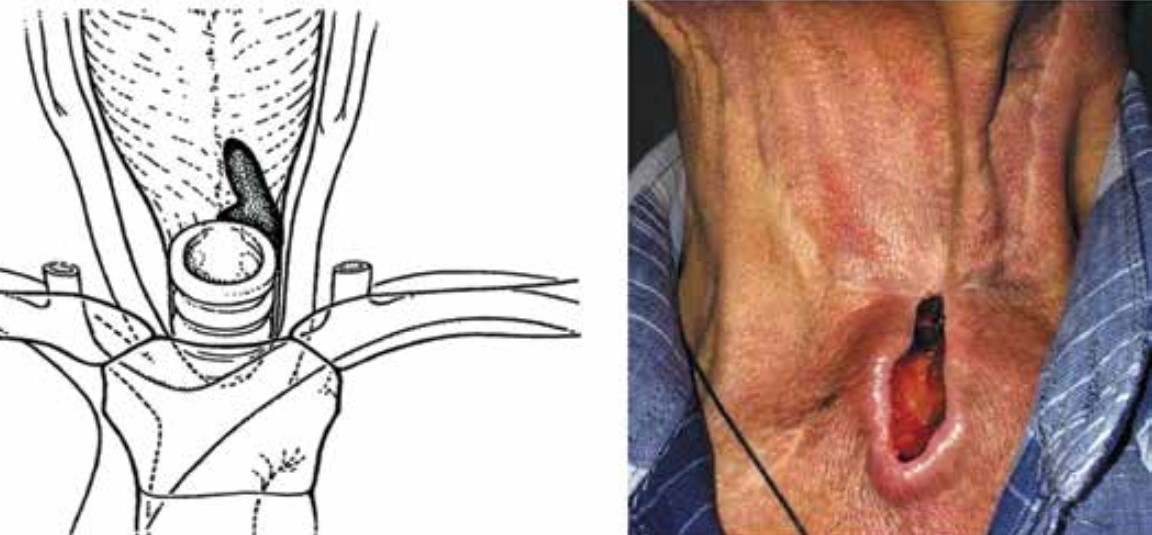
Рис. 2. Представление II стадии перистомального рецидива по G.A. Sisson (адаптировано из [12]) и фото пациента с указанной стадией
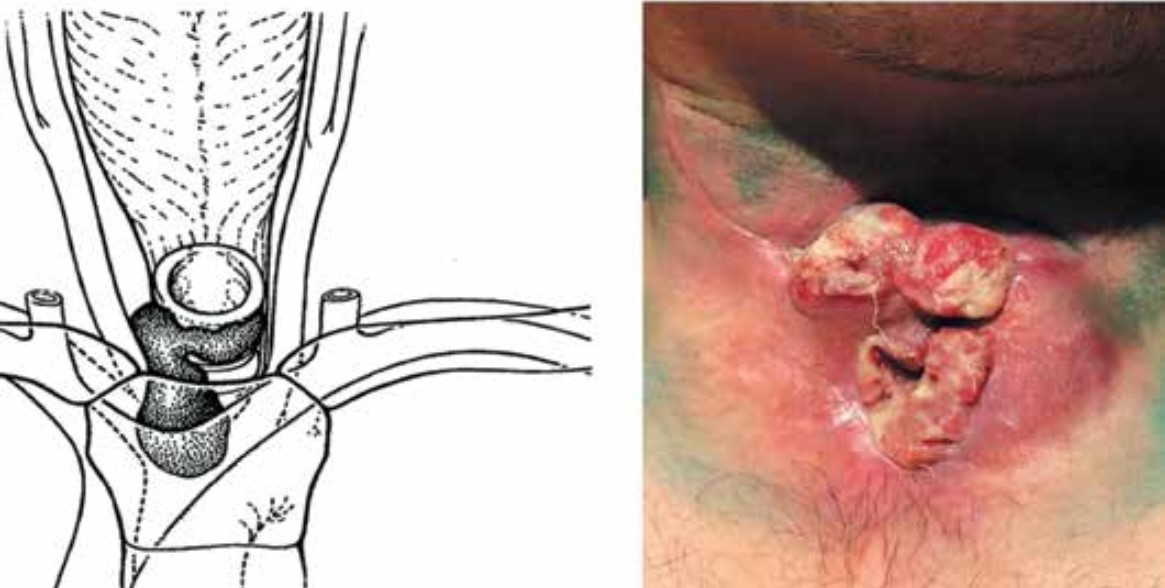
Рис. 3. Представление III стадии перистомального рецидива по G.A. Sisson (адаптировано из [12]) и фото пациента с указанной стадией
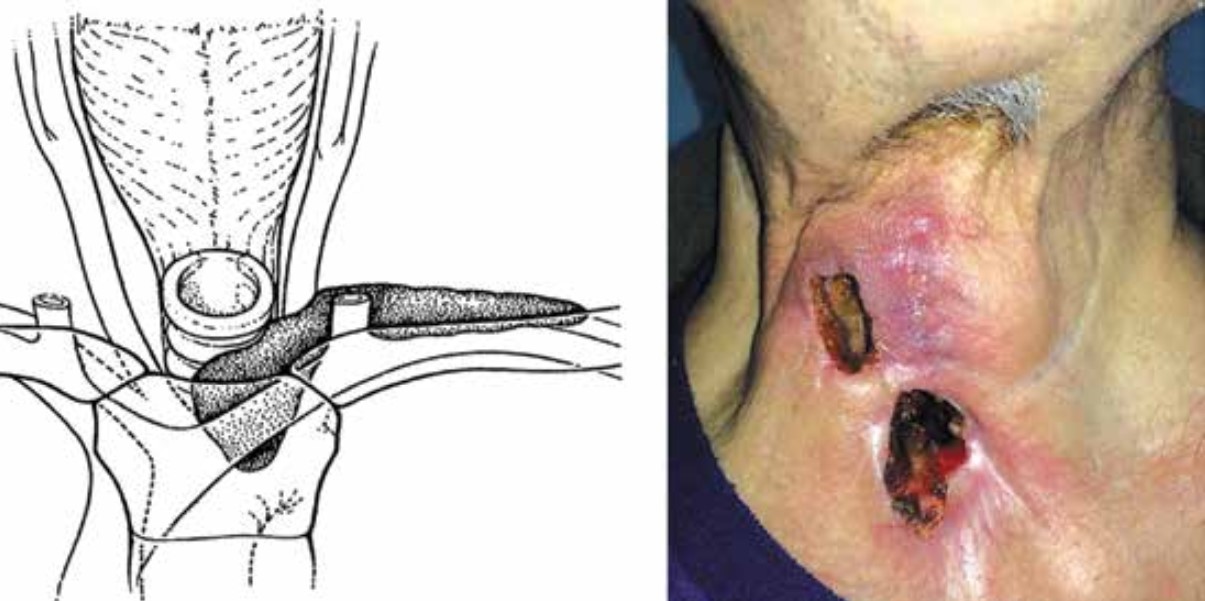
Рис. 4. Представление IV стадии перистомального рецидива по G.A. Sisson (адаптировано из [12]) и фото пациента с указанной стадией
С момента публикации 1-й статьи в 1965 г. различные авторы провели большое количество исследований на тему ПР в поисках путей решения этой проблемы. Достаточно много работ посвящено выявлению факторов, повышающих риск развития рецидива. В частности, L.P. Kowalski и соавт. [13] провели метаанализ публикаций на тему ПР, где проанализировали медицинские документы 18 174 пациентов, прооперированных по поводу рака гортани, по которым в 957 (5,3 %) случаях диагностирован ПР.
Среди основных факторов формирования рецидива многие авторы называют локализацию опухоли в подскладочном отделе гортани, стадию заболевания, наложенную до лечения трахеостому, метастазы в паратрахеальные лимфоузлы и гистологическое строение опухоли. Кроме этого, обсуждается влияние инвазии опухоли в щитовидную железу, имплантация опухоли (во время интубации или при проведении резекции гортани [14]) и наконец просто развитие 2-й опухоли в трахее.
Другим значимым фактором, который вызывает трудности при анализе причин рецидива, является большое число синонимов, используемых для описания этого патологического процесса, – трахеальный метастаз, перитрахеальный и трахеальный рецидив, паратрахеостомальная опухоль, метастаз в стенку трахеостомы, 2-я первичная опухоль в трахее [7]. Многообразие синонимичных терминов, используемых различными авторами в своих работах, затрудняет сбор, систематизацию и анализ получаемых результатов.
Размер первичной опухоли и ее локализация в гортани, кроме того, что является важным критерием в выборе тактики лечения, служит самостоятельным фактором прогноза заболевания, а также значимым признаком развития стомального рецидива. В исследовании Z. Petrovic и V. Djordjevic [1] проанализированы результаты лечения 402 пациентов после выполненной ларингэктомии. У 37 (9,2 %) из них в процессе наблюдения диагностирован рецидив в области трахеостомы. Рецидив вокруг трахеостомы с распространением опухоли T3 возник у 8,0 % пациентов, с T4 – у 11,0 % пациентов (р > 0,05). При анализе локализации опухоли отмечено, что 33,0 % рецидивов развивались у пациентов с локализацией в подскладочном отделе гортани, и только у 15,0 % пациентов – в среднем отделе (р < 0,01).
В исследовании A. Goodale и K. Casper [15] также не отмечено связи между размером первичной опухоли и развитием рецидива, но авторы обращают внимание, что при проведении лучевой терапии у пациентов с T4 сохраняются риски развития стомального рецидива. У 50,0 % пациентов с рецидивом опухоль была расположена в подскладочном отделе гортани.
Лимфатический аппарат гортани имеет сложное строение. Исследовавший лимфатический коллектор гортани P.R.W. De Santi [16] и D.G. Deschler и T. Day [17] показали, что, передняя часть подскладочного отдела дренируется в лимфатические узлы VI уровня и предтрахеальные лимфатические узлы через перстневидно-щитовидную мембрану, а задняя часть подскладочного отдела гортани – в паратрахеальные лимфатические узлы VII уровня, расположенные вдоль возвратных гортанных нервов с 2 сторон. Кроме этого, H. Rouviere [18] еще 85 лет назад указал на большую сетьлимфатическиханастомозовмеждулимфатическими узлами нижней и средней яремной группы, верхнего средостения и пре- и паратрахеальными. Данные анатомические особенности нашли свое подтверждение в клинической практике.
У пациентов с клинически неопределяемыми метастазами рецидив в области трахеостомы возник в 5,1 % случаев при наличии клинически определяемых метастазов (N+), причем до хирургического лечения рецидив выявлен у 21,0 % пациентов (р < 0,05). Кроме этого, при проведении лимфаденэктомии VI уровня [17] из 174 пациентов у 33 (9,0 %) были выявлены метастазы. Рецидив с положительными лимфоузлами развился у 15,0 % пациентов против 9,0 %, у которых поражения паратрахеальных лимфатических узлов не обнаружено (р > 0,05) [6]. В своих исследованиях J. Yotakis и соавт. [7], F. Chiesa и соавт. [19], P. Zbären и соавт. [20] и R.S. Weber и соавт. [21] неоднократно подчеркивали связь между поражением пред- и паратрахеальных лимфатических узлов и развитием стомального рецидива.
Первыми наблюдениями о влиянии предоперационной трахеостомии на развитие ПР поделились в 1965 г. W.F. Keim и соавт. [5], отметив, что рецидив у пациентов, которым трахеостома было наложена более чем за 2 дня до операции, развился в 41,0 % случаев (у 9 из 22 прооперированных) против 14,0 % в группе пациентов с интраоперационной трахеостомией. Позже эти сведения нашли подтверждение в работе L.P. Kowalski и соавт.: 22,9 % рецидивов в группе пациентов с трахеостомой против 7,0 % в группе без трахеостомы [13]. J.J. Debain и соавт. [22] сообщили, что из 12 случаев стомального рецидива в 10 случаях трахеостома была наложена до операции.
Противоположные данные получили в своем исследовании J. Yotakis и соавт. [7], когда при обследовании группы из 71 пациента с ПР не нашли разницы между пациентами, у которых трахеостома было наложена до ларингэктомии (23,3 %) и интраоперационно (18,2 %). К аналогичным выводам пришли A. Goodale и K. Casper [15] и A.L. Sartini и соавт. [8]: в своем анализе они не отметили увеличения риска развития ПР у пациентов с наложенной до лечения трахеостомой.
Разнообразие полученных за полвека результатов свидетельствует о том, что механизм развития рецидива в трахеостоме, связанный с наложением экстренной трахеостомы, недостаточно изучен и требует дополнительного наблюдения и обобщения. Кроме этого, следует учитывать тот факт, что выполнение трахеостомы по экстренным показаниям напрямую связано со стадией опухолевого процесса (чаще при T3, Т4 стадиях), а это является самостоятельным фактором риска развития ПР.
Влияние лучевой терапии на развитие стомального рецидива изучали J.C. Breneman и соавт. [23]. Пациентам с ранее наложенной трахеостомой перед ларингэктомией проводили с целью снижения риска рецидива курс лучевой терапии в режиме гипофракционирования до суммарной очаговой дозы 20 Гр, но ожидаемых результатов не было достигнуто – уровень стомальных рецидивов составил 10,0 %. Авторы рекомендуют замену дооперационной лучевой терапии на послеоперационную адъювантную с более высокой дозой облучения. Ее проведение после ларингэктомии показано пациентам с высоким риском развития рецидива, который определяется на основании данных гистологического заключения.
В 2004 г. Z. Petrovic и V. Djordjevic провели исследование по применению послеоперационной лучевой терапии в лечении рака горла: по их результатам, рецидивы возникали реже в группе с послеоперационной лучевой терапией (6,1 %), чем в группе без лучевой терапии (12,7 %) (р < 0,05) [1].
Анализ гистологических данных опухолей не выявил связи между степенью дифференцировки опухоли и увеличением риска развития ПР [14]. S.P. Reddy и соавт. [24] при анализе белка р53 в гистологических образцах опухоли не выявили прямой зависимости в гиперэкспрессии белка с увеличением риска возникновения ПР. В настоящее время данные о влиянии вируса папилломы человека на развитие ПР в специализированной медицинской литературе не представлены.
Всего несколько работ было опубликовано по изучению влияния частичных ларингэктомий (открытых резекций гортани) на возможность развития стомального рецидива. В своих публикациях E.M. Myers и J.H. Ogura [14], L. Bignardi и соавт. [25] соглашаются с возможным развитием рецидива, если опухолевые клетки диссеминируют и имплантируются на слизистую трахеи, поврежденную при операции или интубации [27]. Эта гипотеза в работах других авторов H.A. Condon [27] не нашла своего подтверждения.
ПР – это одно из грозных осложнений рака гортани, которое встречается у пациентов после ларингэктомии в 2–15 % случаев [29] и имеет очень плохой прогноз: 2-летняя выживаемость составляет 45,0 % у пациентов с I и II стадиями рецидива (по G. Sisson) и 9,0 % – с III и IV стадиями [26].
Особо хотелось бы подчеркнуть необходимость тщательного динамического наблюдения специалистами по опухолям головы и шеи пациентов при наличии у них факторов риска, так как стомальный рецидив развивается в течение 1–2 года после окончания специального лечения [9, 29].
Факторами, влияющими на развитие рецидива, являются: расположение опухоли в подскладочном отделе гортани, размер первичной опухоли, наличие регионарных метастазов, наложенная до ларингэктомии трахеостома, подслизистое распространение опухоли на трахею. Скорее всего наличие 1 фактора не увеличивает риск развития стомального рецидива, но в совокупности их сочетание является неоспоримым в развитии неблагоприятного прогноза. Это, в свою очередь, необходимо учитывать при назначении адъювантной терапии и выборе лечения у первичных пациентов, воздействуя всеми возможными методами на эти патогенетические механизмы развития стомального рецидива.
J. Yotakis и соавт. рекомендуют следующий алгоритм лечения. При наложении в течение 48 ч экстренной трахеостомии по поводу опухолевого стеноза гортани выполнять ларингэктомию, если имеется распространение опухоли в подскладочный отдел гортани, а также геми- или тиреоидэктомию с обязательной паратрахеальной лимфаденэктомией и последующим проведением лучевой терапии на лимфоузлы средостения и трахеостомическое отверстие [7].
Более радикальные превентивные меры предлагает X. León и соавт. [29]: при поражении подскладочного отдела поводить дистальную резекцию трахеи (не менее 3 см), систематическую гемитиреоидэктомию, а при подозрении на инвазию – тиреоидэктомию, паратрахеальную лимфаденэктомию и в адъювантном режиме лучевую терапию на трахеостому и верхнее средостение в дозе 50–65 Гр (в зависимости от результатов гистологического заключения). В случаях, когда пациенту была наложена трахеостома более чем за 48 ч до ларингэктомии, эти же авторы предлагает широкое иссечение кожи и мягких тканей вокруг трахеостомы, включая ткани старого трахеостомического отверстия, и формирование нового, более низкого отверстия с последующим облучением в дозе 50–65 Гр. В своих исследованиях авторы отмечают снижение уровня стомального рецидива благодаря таким мерам.
Таким образом, при многообразии оценок клинической картины и факторов формирования ПР при раке гортани требуется современная оценка с учетом комплексного подхода к лечению основного заболевания с целью достижения низкого уровня развития стомального рецидива.
К сожалению, небольшое число авторов, занимающихся изучением ПР, а также незначительное количество публикаций свидетельствуют об актуальности темы ПР и важности нового взгляда с учетом достижений современной медицины. Из-за небольшой распространенности ПР необходимо проведение многоцентровых клинических исследований в специализированных онкологических учреждениях, оказывающих помощь пациентам с опухолями головы и шеи, чтобы получить достоверные клинические данные.
В исследование включены 60 человек в возрасте от 40 до 70 лет. Оценены показатели функции внешнего дыхания (ФВД) больных раком гортани после ларингэктомии и органосохраняющих операций на этапах восстановления голосовой функции в сравнении со здоровыми лицами.
В РФ за последние 10 лет IV ст. рака гортани у больных с впервые установленным диагнозом составляла в 1995 г. – 14,9%, в 2004 г. – 16,08%.
Подпишитесь на рассылку от портала rak-gortani.ru
Будьте в курсе последних новостей и мероприятий!